KUIS 8
chapter 13
1. Data percobaan dari reaksi : NH4+ (aq) + NO (aq) N2 (aq) + 2H2O (l)
Tentukan rumus kecepatan reaksi berdasarkan percobaan diatas!
Penyelesaian :
Gambar 2
Maka :
Rumus kecepatan reaksinya adalah = r = k[NO2-][NH4+]2
2. Dari reaksi : 2NO (g) + 2H2 (g) N2 (g) + 2H2O (g) Diperoleh data sebagai berikut :
Gambar3
a. Tentukan Orde reaksi dari data di atas!
b. Tentukan persamaan laju reaksi tersebut!
Penyelesaian :
a. Gambar4
Reaksi terhadap NO orde = 1
Reaksi terhadap H2 orde = 1
Orde reaksi = 1 + 1 = 2
b. Menentukan pangkat reaksi NO, dengan laju reaksi untuk H2 tetap.
Menentukan pangkat reaksi H2, laju reaksi untuk [NO] tetap
Jadi persamaan laju reaksinya adalah : V = k [NO] [H2]
1. Tetapan kesetimbangan dari reaksi SnO2 + 2H2(g) ⇔ Sn(s) + 2H2O(l) adalah ….
a. Kc = [H2O]2/[H2]2
b. Kc = [Sn][H2O]2/[Sn][H2]2
c. Kc = [Sn]/[SnO2]
d. Kc = [2H2O]/[2H2]
e. Kc = [H2O]2/[SnO2] [H2]2
alasan :
misal aA + bB <-> cC + dD
kc= (C)c (D)d / (A)a (B)b
1. Derajat keasaman dari larutan 100 ml H2SO4 0,02 M adalah . . . .
a. 2 – log 4
b. 2 + log 4
c. 2 + log 2
d. 12 + log 4
e. 12
Pembahasan:
H2SO4 merupakan asam kuat, bervalensi 2
[H+] = Ma x Val
= 0,02 x 2 = 4 x 10-2
pH = -log 4 X 10-2
= 2-log 4
Jawaban: A
2. Berapakah konsentrasi ion [OH–] dalam larutan jika konsentrasi H+ = 2 X 10-4 M (Diketahui Kw = 10-14)…….
a. 5 X 10-10
b. 5 X 10-18
c. 0,2 X 10-10
d. 0,2 X 10-8
e. 2 X 10-10
Pembahasan:
Dalam larutan dengan pelarut air, berlaku :
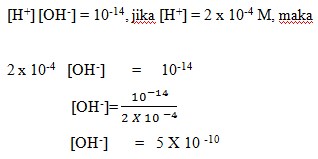
Jawaban: A
8. Larutan asam lemah NH4OH 0,1 M,dan Kb = 10-5 , nilai pH larutan tersebut adalah… . .
a. 11
b. 3
c. 9
d. 14
e. 6
1. Larutan CH3COOH 0,1 M terionisasi dengan derajat ionisasi α= 0,01 mempunyai pH sebesar…..
a. 1
b. 2
c. 3
d. 4
e. 5
Penyelesaian :
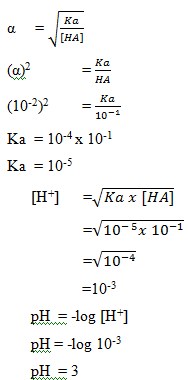
Jawaban : C
2. Terdapat 100 mL larutan NH4OH 0,1 M, Kb NH4OH = 10-5. Maka konsentrasi ion OH– adalah…..
a. 10-3 M
b. 10-1 M
c. 10-2 M
d. 10-6 M
e. 10-5 M
Penyelesaian :
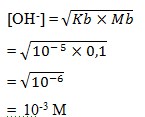
Jawaban : A
2. Sebuah mesin pesawat mengambil 9200 J panas dan membuang 6000 J setiap siklus. a) Berapa kerja mekanik keluaran dari mesin setiap siklus? b) Berapa efisiensi termal dari mesin?
1. Bila diketahui potensial elektrode standar dari :
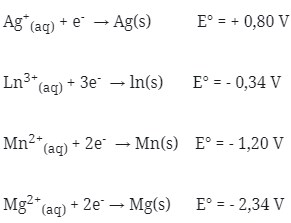
Pasangan sel volta yang akan menghasilkan potensial sel sebesar 0,86 V adalah …
a. ln|ln3+||3Ag+|3Ag
b. Mg|Mg2+||Mn2+|Mn
c. Mn|Mn2+||2Ag+|Ag
d. 2ln|2ln3+||3Mn2+|3Mn
e. 3Mn|3Mn2+||2ln3+|2ln
Jawaban : E
Pembahasan :
Dicari satu persatu potensial sel dari pilihan jawaban
(a) E°sel = E°katode – E°anode
= +0,80 – (- 0,34 ) = 1,14 V
(b) E°sel = E°katode – E°anode
= -1,20 – (-2,34) = 1,14 V
(c) E°sel = E°katode – E°anode
= + 0,80 – (-1,20) = 2 V
(d) E°sel = E°katode – E°anode
= – 1,20 – (- 0,34) = – 0,86 V
(e) E°sel = E°katode – E°anode
= – 0,34 – (- 1,20) = 0,86 V
Jadi, jawaban yang benar adalah E
2. Diketahui :
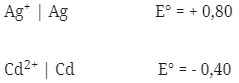
Potensial sel yang dihasilkan dari pasangan elektrode Cd dengan Ag adalah …
a. 0,40 V
b. 0,44 V
c. 0,76 V
d. 0,80 V
e. 1,20 V
Jawaban : E
Pembahasan :
Logam yang memiliki E° lebih kecil selalu merupakan anode (mengalami oksidasi) berarti yang sebagai anode Cd dan sebagai katode Ag.
Notasi Selnya :
Cd|Cd2+||Ag+|Ag
E°sel = E°katode – E°anode
= + 0,80 – (-0,40)
= 1,20 V







Tidak ada komentar:
Posting Komentar